Вплив “Лакто” на клінічний перебіг, імунологічні та мікробіотичні зміни при гострих кишкових інфекціях
УДК 616.926-085.34
М.Д. ЧЕМИЧ, К.С. ПОЛОВ’ЯН
Резюме. У статті наведені результати дослідження впливу комбінованого пробіотика на перебіг гострих кишкових інфекцій, викликаних умовно патогенними мікроорганізмами, імунологічні, мікробіотичні зміни та інтегративні показники ендогенної інтоксикації. Доведено, що використання “Лакто” сприяє нормалізації популяційного складу мікробіоти товстої кишки та зменшенню запально-деструктивних змін у ШКТ, що призводить до швидшої нормалізації випорожнень, скорочення тривалості больового синдрому і терміну перебування хворого у стаціонарі.
Ключові слова: гострі кишкові інфекції, умовно патогенна мікрофлора, дисбактеріоз, цитокіни, інтегративні показники ендогенної інтоксикації, комбінований пробіотик.
ВСТУП
У розвинених державах і в країнах третього світу серед збудників позашпитальних і нозокоміальних інфекцій лідирують умовно патогенні мікроорганізми (УПМ) родини Enterobacteriaceae [1]. Україна не стала винятком – превалювання полірезистентних УПМ у етіологічній структурі гострих кишкових інфекційних захворювань (ГКІ) призвело до пошуку лікувальних середників, що мають найменший негативний вплив на рівень ендогенної інтоксикації, популяційний склад мікрофлори різних біотопів організму тощо [2]. У практиці інтерніста для лікування ГКІ, що викликані УПМ, часто застосовуються комбіновані пробіотики як альтернатива традиційній етіотропній терапії [3]. Але існування ефекту біосумісності резидентної і пробіотичної мікробіоти зумовило проблему відтворюваності лікувальної дії пробіотиків у дорослих імунокомпетентних осіб, що потребує поглибленого вивчення ефективності даних лікувальних середників [4]. Встановлено, що імунні параметри мають найбільш високий прогностичний ранг, а маніфестація і розвиток патологічного процесу визначається узгодженістю змін про- та протизапальних цитокінів [5, 6]. Також, враховуючи, що при ГКІ, викликаних УПМ, місцем безпосередньої дії пробіотиків є уражений кишечник, не викликає сумнівів необхідність вивчення стану мікробіоценозу кишечнику для встановлення клініко-лабораторної ефективності терапії [7].
МЕТА ДОСЛІДЖЕННЯ
Встановити вплив комбінованого пробіотика “Лакто” на клінічний перебіг, імунологічні та мікробіотичні показники при ГКІ, викликаних УПМ.
МАТЕРІАЛИ ТА МЕТОДИ
Обстежено 50 хворих, госпіталізованих у СОІКЛ ім. З.Й. Красовицького, середній вік яких склав (41,62±2,73) роки. За даними анамнезу життя та об’єктивним обстеженням, супровідна патологія ШКТ та гепатобіліарної системи була відсутня. Серед обстежених було 27 чоловіків і 23 жінки. Пацієнти госпіталізовані на (1,34±0,08) добу від початку захворювання. У залежності від призначення лікувальних середників проведений розподіл хворих на дві групи, співставимі за етіологією, клінічними формами і ступенем зневоднення, по 25 осіб у кожній. 1-а група пацієнтів отримувала базисну терапію – промивання шлунка і/або кишечнику, дієту, регідратацію, ферменти та ентеросорбенти. Хворим 2-ої групи на тлі базисної терапії призначали “Лакто” (Saccharomyces boulardii, Lactobacillus sporogenes, Lactobacillus rhamnosus, Bifidobacterium longum по 0,325х109 кожного виду в 1 капсулі) по 1 капсулі тричі на добу за 30 хвилин до їди протягом 5 днів. Крім загальноклінічних обстежень у всіх осіб були досліджені мікробіоценоз кишечнику, рівні вмісту IL-1β, IL-4, IL-6, IL-10 і sIg A у сироватці крові до початку лікування і на (5,63±0,14) добу з моменту госпіталізації. Контрольну групу склали 20 клінічно здорових донорів.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
У пацієнтів, що спостерігалися, бактеріологічне та серологічне підтвердження діагнозу здійснено в усіх випадках. Етіологічним чинником частіше була Kl. pneumoniae (34 %). В однакової кількості хворих – по 5 осіб (10 %) – виявляли St. aureus і Enterobacter cloacae і по 4 особи (8 %) – Proteus mirabilis і Pseudomonas aeruginosae. Серед збудників меншість склали Citrobacter freundii (6 %) і Е. coli гемолізувальна (4 %), а ЕПКП 01, Proteus rotberi і Providencia inconstans A зустрічалися в поодиноких випадках (по 2 %).
У досліджуваних групах серед клінічних форм ГКІ переважно реєструвалася гастроентеритна (1-а група – 76 %, 2-а – 72 %), тоді як ентеритна форма недуги зустрічалася в 5,6 разу рідше (1-а група – 16 %, 2-а – 12 %). Прояви гастроентероколіту були в одної особи (4 %) з 1-ї групи та у трьох (12 %) з 2-ої (p>0,05). По одному хворому з кожної групи (4 %) було діагностовано гастритну форму.
Під час госпіталізації в усіх хворих було встановлено середній ступінь тяжкості недуги, а типові для ГКІ симптоми зустрічалися з однаковою частотою в пацієнтів обох груп (рис. 1).
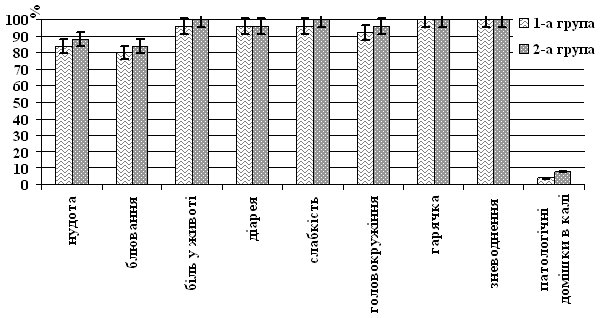

Рис. 1. Частота виявлення клінічної симптоматики в обстежених хворих
Виходячи з анамнезу захворювання, до початку лікування частота блювання (1-а група (5,92±1,31), 2-а – (5,73±1,26) рази на добу, p>0,05), випорожнень (відповідно (7,42±1,12) і (6,92±1,11) рази на добу, p>0,05) і ступінь підвищення температури тіла (відповідно (37,62±0,21) і (37,83±0,22) 0С, p>0,05) були однаковими у пацієнтів обох груп.
У період спостереження за пацієнтами тривалість блювання (1-а група (1,05±0,06), 2-а – (1,07±0,06) доби, p>0,05), гарячки (відповідно (2,81±0,46) і (2,56±0,41) доби, p>0,05), наявності ознак зневоднення (відповідно (2,63±0,23) і (2,54±0,22) доби, p>0,05) не залежали від різновиду застосованої терапії, але спостерігалися відмінності у термінах припинення больового та діарейного синдромів (рис. 2).

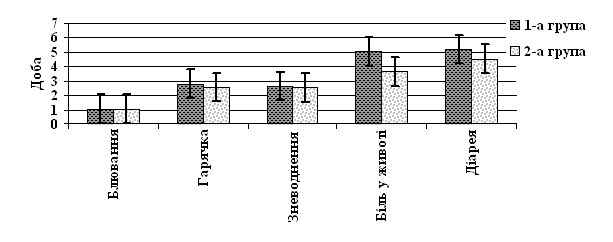
Рис. 2. Вплив різних схем лікування на тривалість основних симптомів ГКІ
Так, у осіб 2-ої групи швидше порівняно з 1-ю зникав біль у животі – на (3,85±0,13) і (5,04±0,23) доби відповідно, р<0,001. Також у хворих, що отримували комбінований пробіотик, у більш ранні терміни відбувалася нормалізація випорожнень (1-а група – (5,20±0,24) доби, 2-а – (4,08±0,12), р<0,001). Наявна різниця у тривалості діарейного і больового синдромів обумовила зменшення тривалості перебування в стаціонарі пацієнтів 2-ої групи – (5,07±0,12) доби порівняно з 1-ю (6,33±0,27), р<0,001.
При госпіталізації у хворих 1-ої і 2-ої груп було встановлено зростання порівняно з контролем рівня лейкоцитів (відповідно (9,64±1,10)×109/л, (9,73±1,18)×109/л і (5,99±0,31)×109/л, p<0,05-0,001), але дані показники не перевищували загальноприйнятих значень норми. У період ранньої реконвалесценції в осіб з обох груп спостерігалося зниження вмісту лейкоцитів до (6,47±0,51)×109/л у 1-й групі і (6,38±0,48)×109/л у 2-й, p<0,001. Показники ШОЕ в хворих обох груп у динаміці не відрізнялися від контролю.
Дослідження загального аналізу крові у гострий період захворювання з наступним розрахунком інтегративних показників ендогенної інтоксикації дозволило встановити, що у всіх пацієнтів збільшувалися ЛІІ, ГПІ, ІЗЛК і знижувався Ілім,що не залежало від належності до тієї чи іншої групи (p>0,05) (табл. 1).
Таблиця 1 – Зміни інтегративних показників ендогенної інтоксикації залежно від терміну та використаних лікувальних середників (M±m)
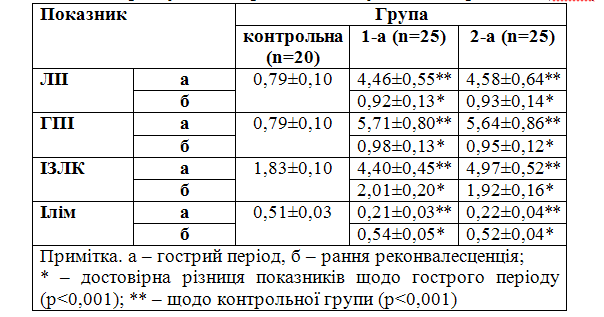
Як видно з таблиці 1, проведення контрольних досліджень крові в усіх реконвалесцентів дозволило встановити зменшення ЛІІ, ГПІ, ІЗЛК до норми порівняно з гострим періодом і показниками контрольної групи (р<0,001). Також відбувалося зростання Ілім у хворих обох груп (р<0,001), що свідчило про нормалізацію кількісного складу лейкоцитарної формули, достатній рівень відповіді клітинної ланки імунітету. При виписуванні зі стаціонару показники ендогенної інтоксикації у досліджених групах були на однаковому рівні (p>0,05), що вказує на безпечність використання “Лакто” при ГКІ, викликаних УПМ, як такого, що не збільшує рівень ендогенної інтоксикації організму.
При госпіталізації у всіх пацієнтів спостерігали зростання порівняно з контролем вмісту про- і протизапальних цитокінів (p<0,001). Так, рівень IL-1β склав (відповідно 1-а, 2-а і контрольна групи) (4,45±0,48), (4,81±0,48) і (1,81±0,03) пг/л; IL-6 – (26,22±1,58), (25,76±1,34) і (1,21±0,16) пг/л; IL-4 – (8,26±0,52), (9,20±0,30) і (0,97±0,13) пг/л; IL-10 – (17,83±0,28), (18,90±0,40) і (0,62±0,13) пг/л відповідно (рис. 3).
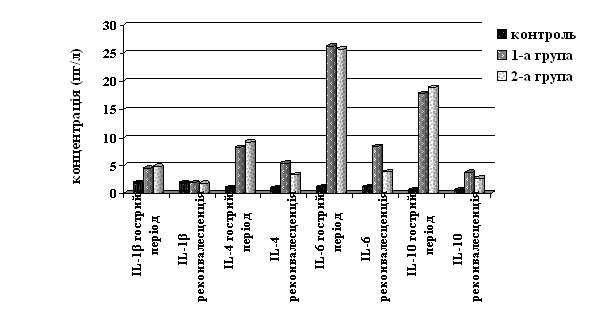

Рис.3. Динаміка рівнів цитокінів у пацієнтів досліджуваних груп
Призначене лікування хворим по-різному вплинуло на регрес досліджуваних цитокінів (рис. 3). Так, у осіб з 1-ої групи концентрації IL-6 (8,43±0,20), IL-4 (5,36±0,43) і IL-10 (3,72±0,22) пг/л знижувалися порівняно з гострим періодом недуги (p<0,001), але не досягали значень норми (p<0,05). У реконвалесцентів 2-ої групи досліджувані показники знизилися порівняно з гострим періодом до значень – IL-6 (3,87±0,29), IL-4 (3,30±0,23), IL-10 (2,70±0,10) пг/л (p<0,001) та були нижчими за рівні 1-ої відповідного періоду дослідження (p<0,05-0,001). Перед виписуванням зі стаціонару в усіх осіб досліджуваних груп рівень IL-1β знизився до норми (p>0,05). Нижчі рівні цитокінів у хворих, що отримували “Лакто”, вказують на меншу виразність запально-деструктивних змін у ШКТ, отже, мінімізацію ризику формування хронічної патології порівняно з пацієнтами, що отримали лише базисну терапію.
На початку лікування в усіх осіб було встановлено зростання в п’ять разів порівняно з нормою sIg A у сироватці крові (1-а група – (20,13±1,25), 2-а – (21,92±0,82) і контроль – (4,05±0,36) мг/л, p<0,001), що є закономірним при стимуляції гуморальної ланки імунітету у відповідь на патоген. Але у період раннього одужання в даних хворих вищий вміст sIg A свідчить про виражене місцеве запалення ШКТ при відсутності скарг. У динаміці концентрація sIg A у всіх обстежених не досягала значень контролю (p<0,001). Вищій рівень вмісту sIg A в сироватці крові хворих 1-ої групи порівняно з 2-ю (відповідно (19,06±1,71) і (10,79±0,61) мг/л, p<0,001) вказує на значніші запально-деструктивні зміни ШКТ та необхідність посилення санації.
При дослідженні мікробіоценозу кишечнику до початку лікування було виявлено, що в обох групах хворих кількість біфідобактерій і лактобацил була на два порядки меншою ніж у донорів при збільшеному рівні інших представників УПМ (р<0,05-0,001) (табл. 2).
Таблиця 2 – Динамічні зміни мікробіоценозу кишечнику (M±m)
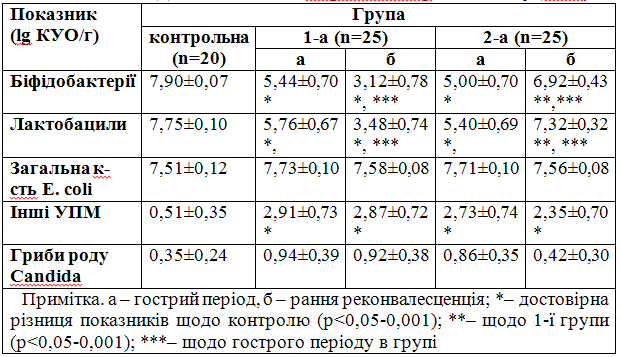
У реконвалесцентів з 1-ої групи (табл. 2) дисбіотичні зміни поглибилися – мікробне число представників мукозної мікрофлори було меншим за гострий період недуги (p<0,05), а кількість інших представників УПМ залишалася на тому ж рівні (p>0,05). На відміну від попередньої групи, у хворих, яким призначали комбінований пробіотик, відбувалося зростання кількості біфідобактерій і лактобацил (p<0,05), але виділення інших УПМ ще продовжувалося (p>0,05). У пацієнтів з обох груп рівні загальної кількості E. coli і грибів роду Candida у гострому періоді та перед виписуванням зі стаціонару практично не відрізнялися від значень контролю.
ВИСНОВКИ
- Включення “Лакто” до складу терапії ГКІ, викликаних УПМ, призводить до швидшої нормалізації випорожнень, скорочення тривалості больового синдрому і терміну перебування хворого в стаціонарі.
- Призначення “Лакто” при ГКІ, викликаних УПМ, є безпечним, так як не відбувається зростання рівню ендогенної інтоксикації організму.
- При використанні комбінованого пробіотика “Лакто” в лікуванні ГКІ, що викликані УПМ, зменшується виразність запально-деструктивних змін у ШКТ і проявів дисбактеріозу кишечнику.
ЛІТЕРАТУРА
- Huang XZ.Characteristics of plasmids in multi-drug-resistant Enterobacteriaceae isolated during prospective surveillance of a newly opened hospital in Iraq. Доступ до матеріалу: http://www.ncbi.nlm.nih.gov/pubmed/22808141.
- Проблема гострих кишкових захворювань в Україні / І.М. Балута, В.В. Мізін, С.І. Вальчук [та ін.] // Проблеми та еволюція епідемічного процесу і паразитарних систем провідних інфекцій сучасності. Мат-ли XV З’їзду українського науково-медичного товариства мікробіологів, епідеміологів та паразитологів ім. Д.К. Заболотного. – Харків: Вид-во ТОВ “НТМТ”, 2011. – С. 57–58.
- Полов’ян К.С. Гострі кишкові інфекції, викликані умовно патогенною мікрофлорою: перспективи досліджень / К.С. Полов’ян, М.Д. Чемич //Сучасні інфекції. – 2010. – № 2. – С. 91–100.
- Копча В.С. Пробиотики: размышления с позиции их качества, эффективности, антибиотикорезистентности и безопасности. Доступ до матеріалу: http://novosti.mif-ua.com/archive/issue-14804/article-14831.
- Басок О.С. Клінічне значення інтерлейкінів та імунної відповіді при сальмонельозі у дітей: автореф. дис. на здобуття наукового ступеня канд. мед. наук: 14.01.13 – “Інфекційні хвороби” / О.С. Басок. – Київ, 2006. – 17 с.
- Ольховська О.М. Особливості клініки кишкових інфекцій з різним варіантом перебігу та цитокінове реагування хворих / О.М. Ольховська // Інфекційні хвороби. – 2010. – № 1. – С. 37–40.
- Fecal microbiota in patients receiving enteral feeding are highly variable and may be altered in those who develop diarrhea / K. Whelan, P.A. Judd, K.M. Tuohy [et al.] // Am. J. Clin. Nutr. – 2009. – № 89. – P. 240–247.
Влияние "Лакто" на клиническое течение, иммунологические и микробиологические изменения при острых кишечных инфекциях
Н.Д. Чемич, К.С. Половьян
В статье приведены результаты исследования влияния комбинированного пробиотика на течение острых кишечных инфекций, вызванных условно патогенными микроорганизмами, иммунологические, микробиологические изменения и интегративные индексы эндогенной интоксикации. Доказано, что использование "Лакто" способствует нормализации популяционного состава микробиоты толстой кишки и уменьшению воспалительно-деструктивных изменений в ЖКТ, что приводит к быстрой нормализации стула, сокращению длительности болевого синдрома и срока пребывания больного в стационаре.
Ключевые слова: острые кишечные инфекции, условно патогенная микрофлора, дисбактериоз, цитокины, интегративные индексы эндогенной интоксикации, комбинированный пробиотик.
Influence of "Lacto" on the clinical course, immunological and microbiological changes in acute intestinal infections
M.D. Chemych, K.S. Polovyan
The results of study of the effect of combined probiotic on the course of acute intestinal infections caused by opportunistic microorganisms, immunological, microbiological changes and integrative indexes of endogenous intoxication. It is shown that the use of "Lacto" helps normalize the population of the microbiota of the large intestine and reduce inflammatory and destructive changes in the gastrointestinal tract, which leads to a more rapid normalization of defecation, reduction of pain and the duration of stay of patients in hospital.
Keywords: acute intestinal infections, opportunistic microflora dysbiosis, cytokines, integrative indicators of endogenous intoxication, combined probiotic.

